- Radiación electromagnética
- Orígenes de la teoría cuántica. Hipótesis de Planck
- Espectros atómicos
- Modelo atómico de Bohr para el átomo de hidrógeno
- Mecánica cuántica moderna y su incidencia en el desarrollo de la química
- Modelo mecano-cuántico
- Orbitales atómicos
- Estructura electrónica de los átomos
- Clasificación periódica de los elementos químicos
- Configuración electrónica externa y sistema periódico
- Propiedades periódicas y su variación en el sistema periódico .
- Carga nuclear efectiva (Presentación. Archivo pdf)
Estructura atómica: de átomos indivisibles al modelo de Rutherford
View more presentations or Upload your own.
- DE LA TABLA PERIÓDICA DE MENDELÉIEV Y MEYER, AL SISTEMA PERIÓDICO ACTUAL. LEY DE MOSELEY
El criterio de ordenación de los elementos conocidos era la masa atómica creciente, pero en 1912, Moseley observó que las frecuencias (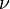 ) de rayos X absorbidas por los átomos de los elementos quñimicos cumplían la ecuación:
) de rayos X absorbidas por los átomos de los elementos quñimicos cumplían la ecuación:
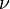 ) de rayos X absorbidas por los átomos de los elementos quñimicos cumplían la ecuación:
) de rayos X absorbidas por los átomos de los elementos quñimicos cumplían la ecuación: 
donde Z repesenta el número atómico 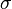 y C son constantes. Más tarde se identificó el número atómico con el nº de prtones existentes en el núcleo. Debido a la importancia de Z en la estructura interna de los átomos, se pensó que era mejor criterio de ordenación de los átomos el uso de Z y no de la masa atómica. Así nació el sistema periódico actual con 18 columnas o grupos y 7 filas o periodos.
y C son constantes. Más tarde se identificó el número atómico con el nº de prtones existentes en el núcleo. Debido a la importancia de Z en la estructura interna de los átomos, se pensó que era mejor criterio de ordenación de los átomos el uso de Z y no de la masa atómica. Así nació el sistema periódico actual con 18 columnas o grupos y 7 filas o periodos.
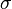 y C son constantes. Más tarde se identificó el número atómico con el nº de prtones existentes en el núcleo. Debido a la importancia de Z en la estructura interna de los átomos, se pensó que era mejor criterio de ordenación de los átomos el uso de Z y no de la masa atómica. Así nació el sistema periódico actual con 18 columnas o grupos y 7 filas o periodos.
y C son constantes. Más tarde se identificó el número atómico con el nº de prtones existentes en el núcleo. Debido a la importancia de Z en la estructura interna de los átomos, se pensó que era mejor criterio de ordenación de los átomos el uso de Z y no de la masa atómica. Así nació el sistema periódico actual con 18 columnas o grupos y 7 filas o periodos.- ANOMALÍAS EN EL RADIO ATÓMICO
 A la vista de la definición de radio metálico, covalente e iónico de la imagen anterior, hemos de señalar algunas anomalías en el radio debido al efecto del valor de la constante de apantallamiento S que vimos anteriormente.
A la vista de la definición de radio metálico, covalente e iónico de la imagen anterior, hemos de señalar algunas anomalías en el radio debido al efecto del valor de la constante de apantallamiento S que vimos anteriormente.- RADIO IÓNICO
ANIONES: En los aniones ocurrirá lo contrario, el radio de los aniones será MAYOR que el de los átomos que los originaron. La nuebe eletrónica sufre una EXPANSIÓN ya que ahora predominan las fuerzas repulsivas (e-e) frente a las atractivas (p-e) por exceso de electrones. Al aumentar la carga de los aniones, mayor será la expansión sufrida.
Con todo ello, sólo podremos comparar las series de IONES ISOLELECTRÓNICOS (igual nº de electrones) sin comparar cationes con aniones.
- ELECTRONEGATIVIDAD: ESCALAS Y VALORES
La escala Mulliken (cM) promedia la afinidad electrónica A.E. (magnitud que puede relacionarse con la tendencia de un átomo a adquirir carga negativa) y los potenciales de ionización de sus electrones de valencia P.I. o E.I. (magnitud asociada con la facilidad, o tendencia, de un átomo a adquirir carga positiva). Las unidades empleadas son el kJ/mol:
Problemas complementarios






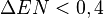





No hay comentarios:
Publicar un comentario