- Híbridos sp: s- p- p- p- (4 OA) dará lugar a sp- sp- p- p- (2 oh + 2oa no hibridados).
- 2 OH sp: disposición lineal (ángulo de 180º)
- 2 OA p, perpendiculares entra si y a los OH sp
- Híbridos sp2: s- p- p- p- (4 OA) dará lugar a sp2- sp2- sp2- p- (3 oh + 1oa no hibridados)
- 3 OH sp2: disposición triangular plana (ángulo de 120º)
- 1 OA p, perpendicular a los híbridos sp2
- Híbridos sp3: s- p- p- p- (4 OA) dará lugar a sp3- sp3- sp3- sp3- (4 oh)
- 4 OH sp3: disposición tetraédrica (ángulo de 109,5º)
Paso 2: Solapamientos de OH con OA de otros átomos o con OH de otros átomos.
Etano
C(OH sp3)- C(OH sp3) = solapamiento sigma
C(OH sp3) - H(OA s) = solapamiento sigma (x3 veces)
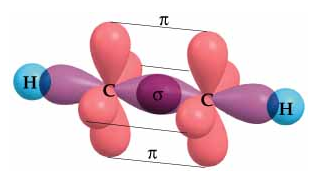
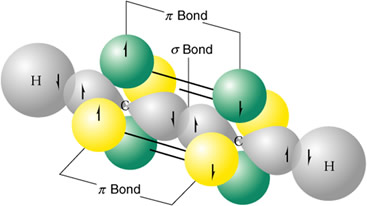
Eteno
C(OH sp2)- C(OH sp2) = solapamiento sigma
C(OA p) - C(OA p) = solapamiento pi
C(OH sp2) - H(OA s) = solapamiento sigma (x2 veces)
Etino
C(OH sp)- C(OH sp) = solapamiento sigma
C(OA p) - C(OA p) = solapamiento pi (x 2 veces en planos perpendiculares)
C(OH sp2) - H(OA s) = solapamiento sigma
Extraordinario vídeo que explica la disposición de orbitales híbridos enlazantes (con ppar de enlace pe) o híbridos con pares de electrones no enlazantes (pne = psolitario = par no compartido).
Hybrid Orbitals in Organic Chemistry from the Wolfram Demonstrations Project by Guenther Gsaller



No hay comentarios:
Publicar un comentario